Изделия из металлов, если их не защищать, под действием различных природных, физико-химических и биологических факторов разрушаются или теряют свои потребительские качества.
Такое разрушение изделий получило название коррозия.
Слово «коррозия» имеет латинские корни и происходит от словосочетания cum+roda, что означает разгрызать.
Явление коррозии известно с древнейших времен, однако, сам термин появился только в 1667 году в английском журнале, где описывалось локальная коррозия бронзовых пушек на острове Ямайка.
В России явление коррозии металлов первым стал исследовать Михаил Ломоносов. Сам термин коррозия появился в русском языке только в начале 20 века, до этого времени данное явление описывали словом «ржавление»
Коррозия – процесс разрушения стенки металла, который приводит к негативным последствиям в виде истончения или полного разрушения.
На протяжении века ученые стараются подчинить процесс коррозии и защитить металлические конструкции.
На данном этапе разработано множество способов защиты от всех видов коррозии, под нужды каждого вида промышленности.
Виды коррозии металлов
Процесс коррозии – совокупность химических и электрических процессов, которые оказывают негативное воздействие на металл. В зависимости от типа воздействия коррозию классифицируют по нескольких признакам.
Коррозионные процессы различаются по:
- Механизму реакций взаимодействия металла со средой:
а) химическое – процесс распада металла происходит в результате химической реакции с жидкостью, которая не проводит электрический ток или сухим газом.
Газовая коррозия возможна только в условиях высоких температур.
Например, если заводскую автомобильную выхлопную трубу заменить незащищенной стальной, то, когда машина заведется, начнется процесс ржавления, так как температура выхлопа составляет 500 ⁰С
б) электрохимическое – процесс, когда на металл действует электрический ток, либо электролит.
При взаимодействии электрического тока с металлом происходит процесс «выбивания» частиц последнего, в результате повреждается только та часть конструкции, которая была в контакте;
в) радиационное;
г) микробиологическое – процесс ржавления происходит в результате воздействия на металл агрессивных микроорганизмов. Данный вид коррозии характерен для подземных коммуникаций.
Но стоит отметить, что отходы жизнедеятельности птиц, также могут привести к началу процесса ржавления, так как в них содержится большое количество бактерий.
- Виду коррозионной среды:
а) почвенная – характерна для трубопроводов, кабелей, опорных конструкций, то есть всего металла, который погружен в землю.
Основными характеристиками коррозионной активности почвы являются ее электропроводность, то есть способность проводить электрический ток, и влажность.
Наиболее активно проводят ток влажные, пористые грунты.
Например, если песок в сухом состоянии практически не проводит ток, то при увлажнении его на 2-3%, его проводимость увеличивается в 20 раз, а после высыхания возвращается в исходное состояние.
Для этого типа коррозионной среды характерны язвенные разрушения металла.
б) атмосферная – данный тип ржавления происходит при нахождении металлов на воздухе.
Быстрота протекания процесса коррозии зависит от типа климата и состава сплава.
В случае если влажность климата ниже 60% происходит сухая коррозия, то есть металл начинает окисляться.
Стоит отметить, что чем жарче климат, тем быстрее протекает сухая коррозия.
Если влажность выше 60%, то процесс разрешения металла происходит быстрее, так как влага проникает в микротрещины и зазоры, что приводит к образованию окисей.
в) морская – самый опасный тип коррозии.
В морской воде ржавление металла происходит под воздействием солей, микроорганизмов и большого количества кислорода, что приводит к быстрому разрушению большинства сплавов.
Стоит отметить, что процесс разрушения будет проходить интенсивнее выше ватерлинии, так как там происходит периодический контакт с водой;
3) Характеру дополнительных воздействий:
а) коррозионное растрескивание – ржавление, которое развивается в местах, стороннего воздействия на металл тяжелых весов;
б) эрозионная коррозия – разрушение, которое происходит при трении в условиях агрессивной среды;
в) кавитационная коррозия – разрушение, которое происходит при ударных воздействиях в условиях агрессивной среды.
Виды поражения металлов коррозией
По характеру изменения поверхности металла или его свойств, независимо от того, какое взаимодействие проходило со средой, коррозионные разрушения подразделяют на несколько видов:
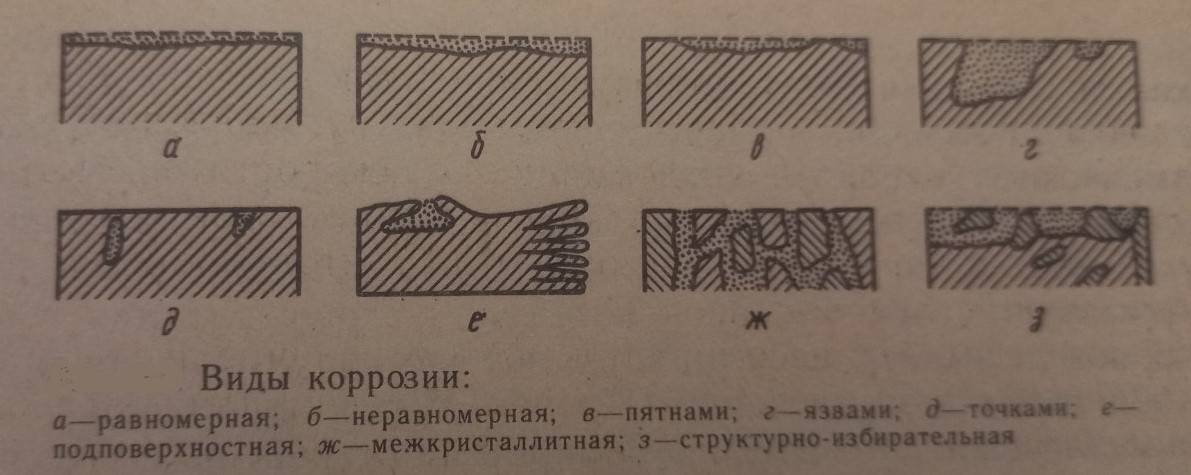
- Сплошная – коррозией охвачена вся поверхность металлической конструкции. Она подразделяется на:
а) равномерную (а) – разрушение идет однородно;
б) неравномерную (б) – разрушение в разных частях конструкции имеет разную глубину.
2. Местная – коррозия захватывает отдельные участки металлической конструкции. В зависимости от степени разрушения происходит деление на:
а) пятна (в) – разрушение отдельных участков металла на небольшую глубину. Например, коррозия латуни в морской воде;
б) язвы (г) - разрешение отдельных участков на большую глубину. Например, ржавление стали в грунте;
г) питтинг (д) – точечный процесс разрушения. По мере прогрессирования коррозия становится сквозной. Например, нержавеющая сталь в морской воде.
д) подповерхностная (е) – возникает, когда антикоррозийные покрытия разрешены на отдельных участках. Поэтому металл разрушается под поверхностью защиты, и разрешения сосредоточены внутри металла;
е) межкристаллитная (ж) – самый опасный вид коррозии. Разрушаются не частицы сплава, а из границы, то есть самые тонкие места;
ж) структурно – избирательная – происходит, когда сплав состоит из нескольких металлов, которые имеют разные коррозионные свойства. Металл, у которого свойства будут ниже начнет разрушаться, при этом остальные элементы сплава останутся целыми.
Способы защиты металлов от коррозии
В процессе совершенствования науки и техники разрабатываются разные способы защиты металлов от разрушения.
В XXI веке способы защиты сплавов условно разделяются на: легирование, физические методы защиты, электрохимические методы, методы замещения материалов и методы уменьшения агрессивных свойств среды.
Легирование
Легирование – изменение изначального состава сплава для усиления определенных свойств.
Метод основан на введении в сплав пассивных металлов, таких как хром, титан, стронций, молибден.
В результате введения легирующих материалов на поверхности сплава образуется плотная пленка, которая обладает большой устойчивостью к агрессивным воздействиям.
Наиболее востребован процесс легирования при защите сплавов от газовой коррозии. Например, все части двигателей машин, производятся из легированных сплавов, которые кроме защиты от агрессивной среды, повышают стойкость металлов к высоким температурам.
Наиболее оптимальными пассивными материалами для увеличения температурной стойкости являются алюминий и хром.
При повышении температур выше 200⁰С в сплавах начинается процесс окисления и образования защитной оксидированной пленки.
Легирование так же применяется для повышения коррозионной защиты от химических воздействий. Например, хром является пассивным элементом, который блокируют появление коррозии в сильнокислых средах.
Защитные покрытия
Защитные покрытия являются оптимальным видом изоляции для подземных и наземных конструкций.
Изоляционные защитные материалы используются во всех сферах строительно – монтажных работ, для защиты металлических конструкций от разрушающих природных и искусственных факторов.
В зависимости от состава изоляционные покрытия подразделяют на две больших группы: металлические и неметаллические.
Неметаллические покрытия
Неметаллические покрытия – органические и неорганические материалы, которые являются изоляторами металлов как от агрессивной среды, так и от действия электрического тока.
Изоляционные материалы применяются в зависимости от назначения металла.
Например, при проектировании подземных конструкций используются материалы на основе резины, битумы и полилены, так как они обладают диэлектрическими, и антикоррозионными свойствами. Проверку износостойкости этих материалов проводят раз в 25 лет.
По результатам проверки, если нет механических повреждений, покрытие оставляют еще на 25 лет.
Если механические повреждения есть, то производится замена поврежденного участка изоляции.
В случаях, когда необходимо обезопасить металл, находящийся на поверхности земли или над ней, используются специальные краски и эмали, в состав которых входит пассивный элемент или стойкий к внешним воздействиям оксид хрома, оксид кремния и т.д.
Такая защита не имеет срока износа и замены, единственное ее необходимо раз в 12 месяцев или по мере истирания подновлять.
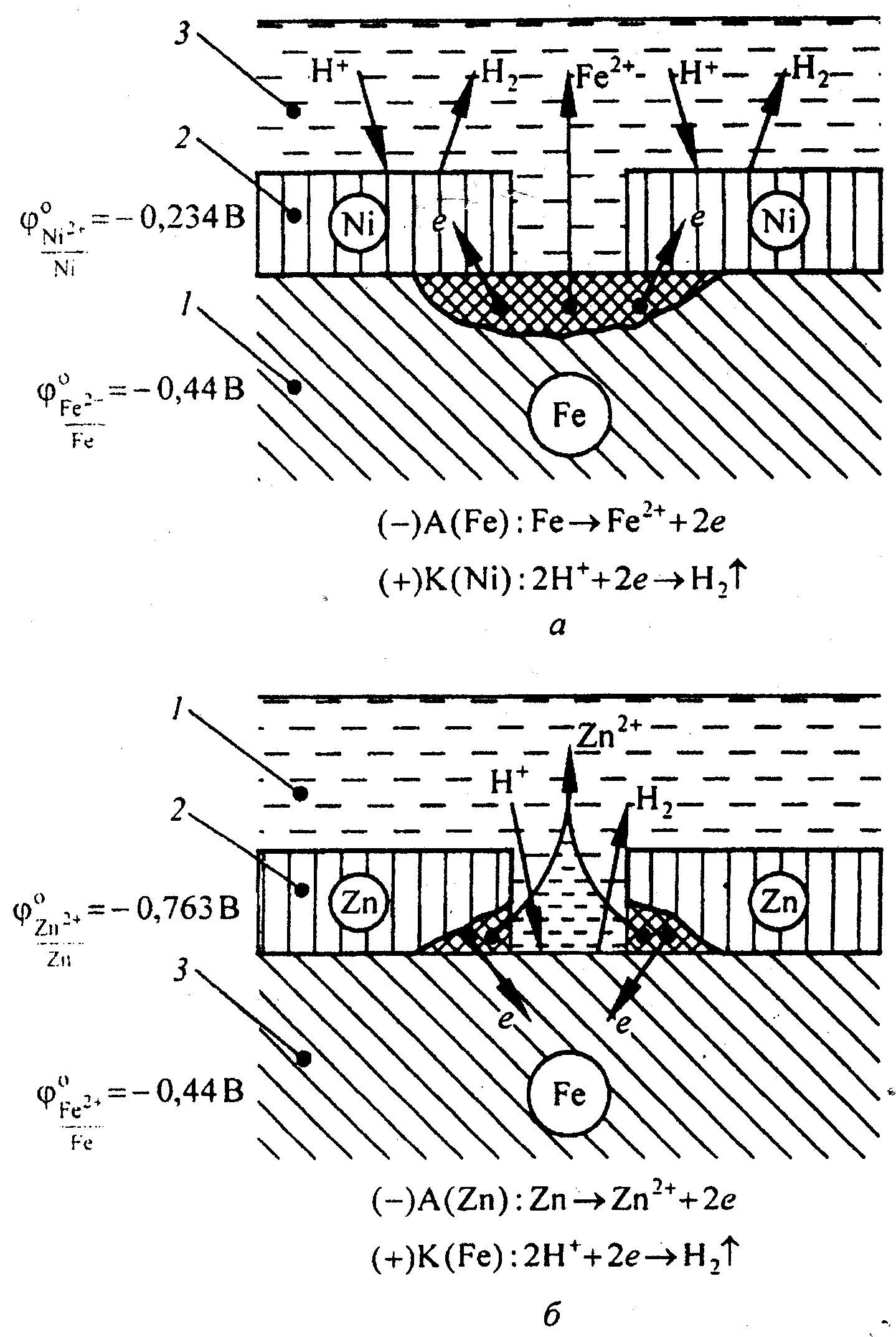
Коррозия железа в кислотном растворе с катодным (а) и анодным (б) покрытиями: 1 – основной металл; 2 – покрытие; 3 – раствор электролита
В качестве защиты от электрохимической коррозии используют пластмассы, которые являются диэлектриками с пассивным элементом в составе.
Металлические покрытия
Главной особенностью металлической изоляции является то, что она работает даже в случае нарушения целостности покрытия.
Пока изоляция не нарушена ее свойства такие же, как и у неметаллических покрытий: полная защита металла от агрессивных воздействий среды и электрического тока.
В случае повреждения изоляции происходит образования гальванического элемента.
Гальванический элемент – это источник тока, который создается за счет химической реакции кислой или щелочной среды с металлом.
В зависимости от типа металла, используемого в изоляции, покрытия подразделяются на:
- катодные – материалы, имеющие потенциалы в положительных значениях в сравнении со сплавом;
- анодные – материалы с более отрицательными потенциалами.
Например, изолируя железо необходимо учитывать, что его потенциал равен -0,44 В. Это означает, что при использовании как изолятор никеля (-0,234В) покрытие будет являться катодным, а при использовании цинка (-0,763В) – анодным.
Если железо, изолированное никелевым покрытием, будет находиться в кислой среде и произойдет повреждение материала (а), то оно начнет окисляться, а покрытие восстанавливаться, так как создастся гальванический элемент.
В результате такого процесса покрытие потеряет свой защитные свойства и начнется процесс коррозии.
Если железо изолировать цинковым покрытием и поместить в ту же среду, то процесс будет идти по-другому.
Потенциал цинка выше, чем потенциал железа, поэтому при повреждении защитного слоя и создании гальванического элемента цинк начнет окисляться, а железо – восстанавливаться.
Данный процесс приводит к тому, что несмотря на разрушающееся защитное покрытие металл продолжит оставаться защищенным.
Металлические покрытия могут быть получены несколькими способами:
- электрохимический – покрытие наплавляют на металл с использованием кислой или щелочной среды, в которую погружены электроды;
- лужение и цинкование – погружение металла в расплавленное покрытие;
- химическое восстановление.
Химические способы
Современные технологии позволили создать десятки способов химической защиты от коррозии.
Существуют уникальные, дорогостоящие методы, такие как покрытие металла золотом и платиной. Их используют в микроэлектроники и машиностроении.
В массовом производстве используются более экономически выгодные методы. Самыми распространёнными являются:
Оксидирование
В основе метода заложено создание на металле специальной защитной пленки – оксида.
Оксидная пленка создается при помещении металла в концентрированный раствор щелочи или кислоты, который нагревается от 130 до 350⁰С, в зависимости от элементов сплава.
Самой распространённой щелочью в оксидировании является едкий натр, а кислоты – нитрат натрия и нитрит натрия.
При помещении металла в раствор концентрированной щелочи, он начинает окисляться, то есть высвобождать электроны:
Ме0↔ Меn+ + n e,
где n – количество окисленных электронов.
Одновременно с этим процессом происходит восстановление щелочи, что приводит к высвобождению гидроксильной группы:
NaOH ↔ Na+ + OH-
Высвободившиеся электроны и гидроксильная группа вступают в реакцию с образованием оксида:
Меn+ + ОН-↔МеmОх
При окислении малоуглеродистой стали оксидная пленка окрашивается в иссиня черный цвет, а у высокоуглеродистой в серо-черный.
Метод оксидирования широко используется в декоративных работах и в ковке.
Фосфатирование
Данный метод основан, как и оксидирование, на создании защитной пленки с использованием высококонцентрированных растров фосфорной кислоты и дигидроортофосфосфата марганца (II) кислоты при невысоких температурах, до 100⁰С.
В результате химической реакции, основанной на окислительно – восстановительных процессах, на поверхности металла образуется пленка, состоящая из пассивных солей: гидрортофосфата марганца (II), дигидроортофосфосфата марганца (III), ортофосфата и фосфата фосфатированного металла.
При рассмотрении окислительно – восстановительного процесса на железе (II), видно, что
Железо в растворе окисляется:
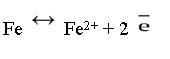
В самом растворе, происходит восстановление водородной группы:
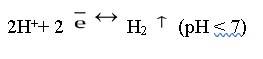
Высвободившиеся электроны взаимодействуют между собой, образуя фосфатные пленки:
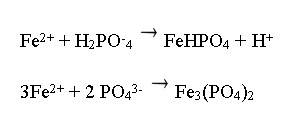
Фосфатные пленки имеют высокий показатель адгезии, что позволяет легко наносить на них лаки и краски.
Однако данный вид защиты от коррозии можно использовать только в закрытых помещениях или как вспомогательный, так как повредить фосфатную пленку достаточно легко.
Анодирование
Метод является разновидностью оксидирования, когда на поверхность металла наносится алюминиевый слой оксида алюминия.
В качестве восстановителя используются концентрированные: серная, хромовая, бороводородная, щавелевая кислоты.
В качестве окислителя выступает алюминий, как восстановитель – водород, из кислоты.
Данный метод используется для покрытия декоративных металлов.
Электрохимические способы защиты от коррозии
Электрохимические способы защиты от коррозии широко используются в строительстве наземных и подземных сооружений.
В основе электрохимической защиты заложен закон сохранения заряда, то есть перехода заряда из одного состояния в другое.
В качестве заряда используется постоянный переход дополнительных электронов для восстановительного процесса металла с катода или анода, в зависимости от типа конструкции. Переход электронов происходит за счет создаваемой связки гальванического элемента.
Катодная защита
Этот тип защиты широко используют для защиты от коррозии подземных газопроводов, сооружений, резервуаров, а также для защиты аппаратуры промышленных предприятий.
Сущность метода заключается в катодной поляризации защищаемого металла: защищаемая конструкция подключается к отрицательному полюсу источника тока, а положительный полюс подключается к болванке металла, то есть к аноду.
Схема катодной защиты
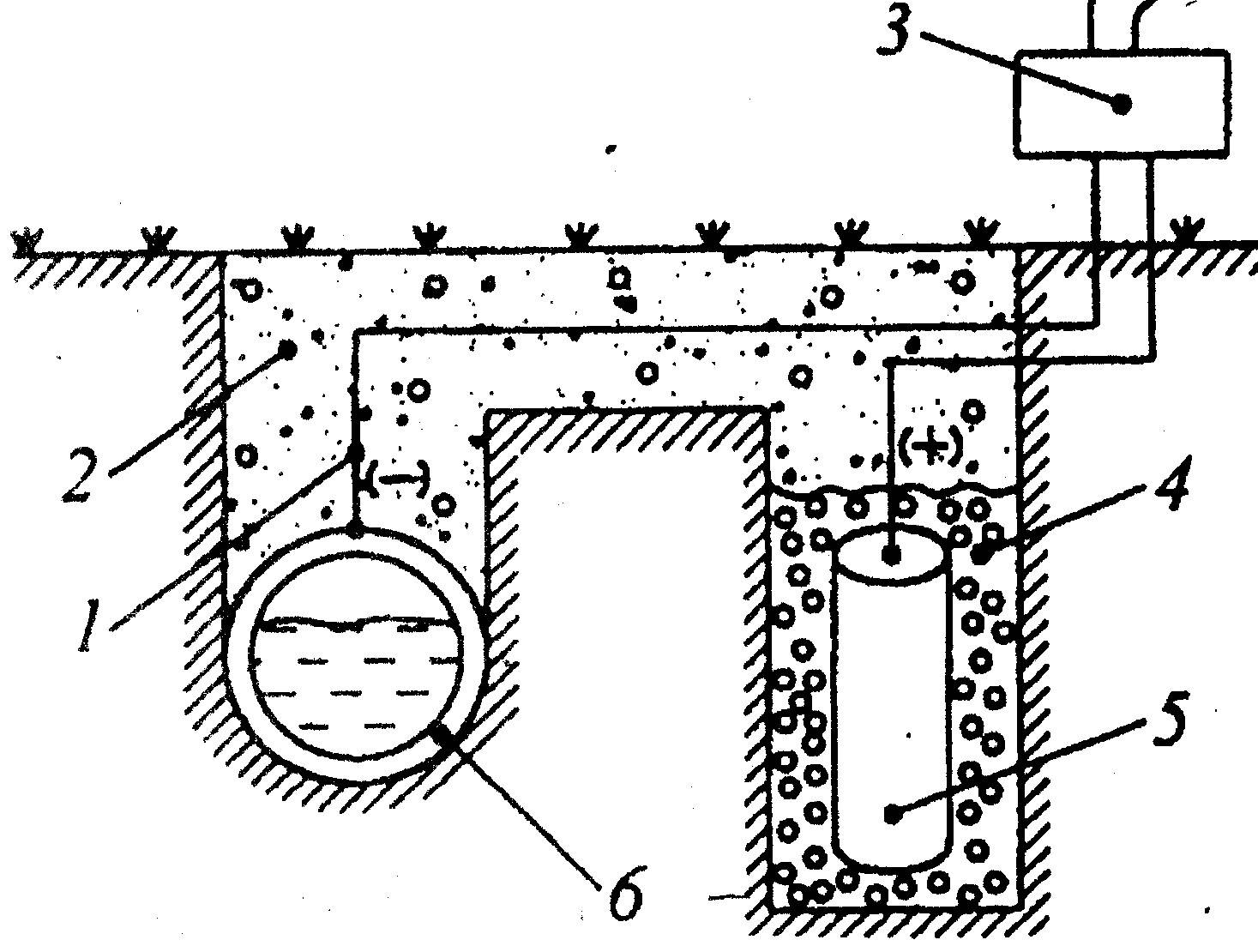
1 – стальной провод с изоляцией; 2 – грунт; 3 – выпрямитель; 4 – засыпка; 5 – вспомогательный анод; 6 – защищаемая конструкция (трубопровод).
При таком подключении защита конструкции происходит за счет постоянных восстановительных процессов, а окислительные процессы будут проходить на аноде (металлической болванке), то есть все разрушающие воздействия будут переходить на анод.
Если монтаж защиты осуществляется в агрессивный грунт, то около анода создается дополнительный токопроводящий слой из смеси кокса, хлорида натрия и сульфата кальция.
Катодная защита хорошо показывает себя для защиты конструкций в средне агрессивных грунтах
Протекторная защита
Универсальная защита трубопроводов, которая не требует стороннего источника питания.
В основу метода положены окислительно – восстановительные реакции.
Протектор (металлическая болванка) является анодом и со временем окисляется, то есть высвобождает электроны. Защищаемая конструкция находится в непрерывном процессе восстановления, так как является катодом.
Пока анод полностью не разрушится, конструкция будет в безопасности.
Схема протекторной защиты
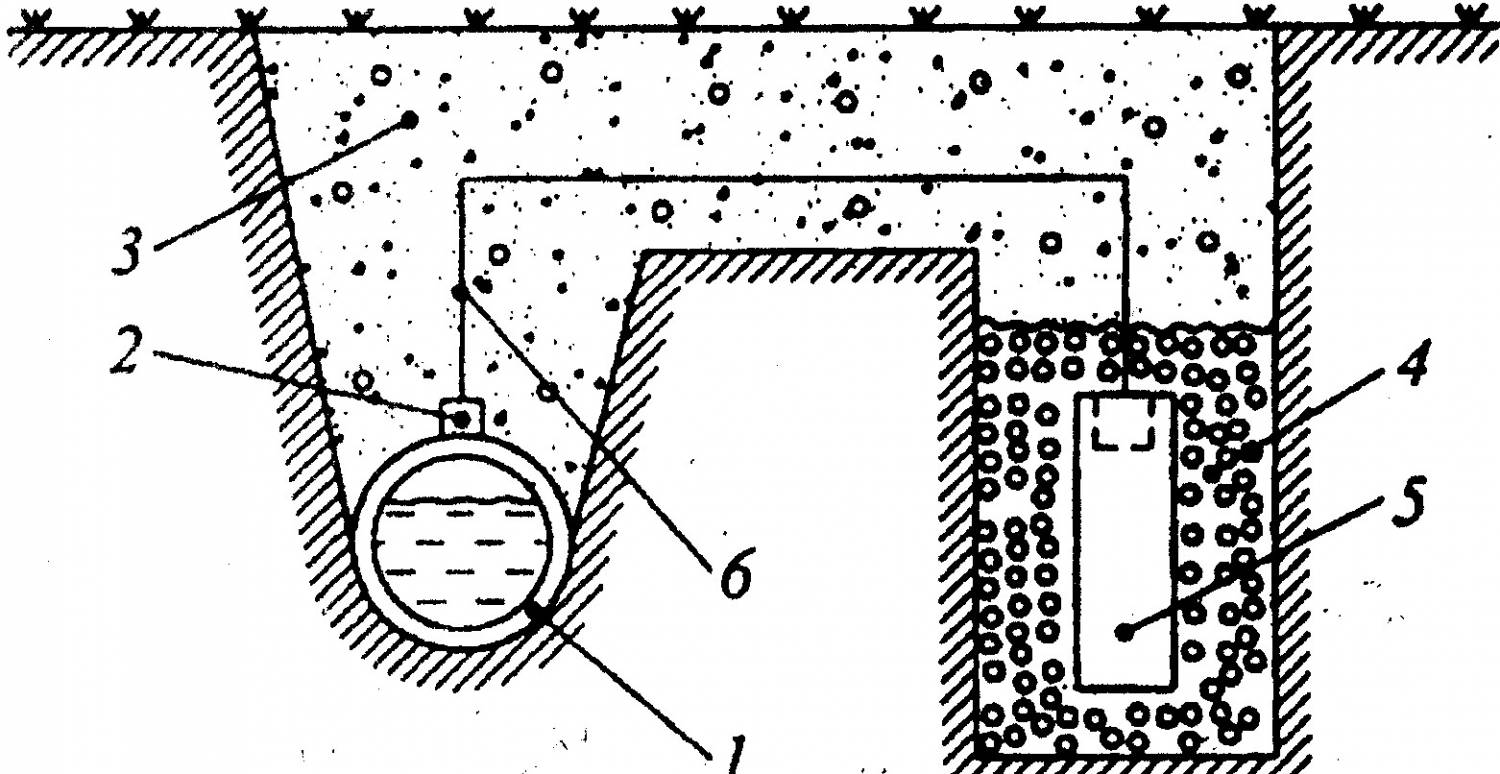
1 – защищаемая конструкция (трубопровод); 2 – стальной наконечник; 3 – грунт; 4 – засыпка (суспензия бентонита и алебастра); 5 – протектор; 6 – стальной провод с изоляцией.
Эффективность защиты определяется расстоянием, на котором может находиться протектор от защищаемой конструкции. Расстояние зависит от токопроводимости грунта, чем она выше, тем дальше можно расположить протектор.
Протекторную защиту как самостоятельный метод борьбы с коррозией используют редко, в основном она идет дополнением к неметаллическим изоляторам.
Анодная защита
Анодная защита используется в тех случаях, когда конструкция состоит из компонентов, которые могут при определенных условиях переходить в пассивное состояние.
За счет создание окислительно – восстановительной цепочки, в которой анодом будет конструкция, а катодом – металлическая болванка. Активатором процесса является источник постоянного тока, который будет создавать поляризацию.
Анодная защита используется в агрессивных средах с хорошей электрической проводимостью.
К пассивным компонентам слава относятся:
- хром;
- никель;
- титан;
- цирконий;
- железные сплавы.
Изменение свойств коррозионной среды
Скорость коррозии конструкций из коррозийных металлов можно снизить изменением состава грунта.
Это достигается удалением коррозийно – активных веществ из почвы. Основными способами удаления являются:
- обдувка инертными газами;
- химическая обработка среды;
- обезвоживание влажных грунтов;
- обескислочивание почвы;
- удаление агрессивных компонентов с помощью абсорбции.
Самым распространённым способом является введение в агрессивную среду ингибиторов, то есть компонентов, которые замедляют вредоносные процессы.
Видов коррозии металлов, как и способов защититься от нее достаточно много.
Для длительного служения конструкции необходимо правильно выбирать способ защиты от коррозии исходя не только из свойств того или иного металла, но и внимательно изучая грунты, климат и атмосферу в месте строительства.
Если пренебречь сбором информации и расчетами, даже самая качественная конструкция прослужит недолго.